GMP (Good Manufacturing Practice)

국내 GMP관련 법령체계

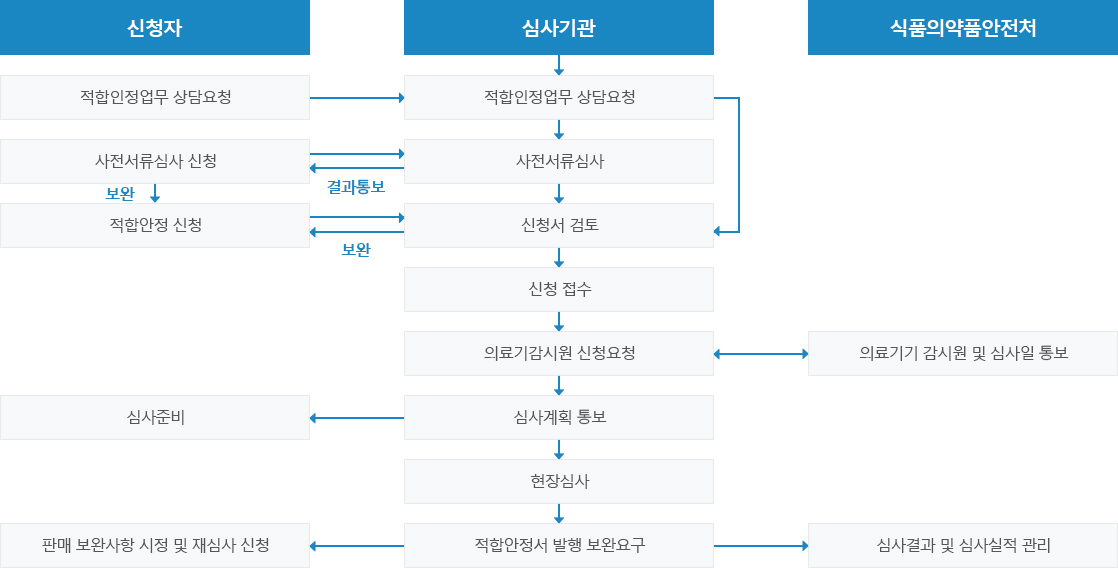
GMP적합성 평가 세부절차
 GMP 적합인정 표시
GMP 적합인정 표시
GMP 적합성평가 신청 구비서류
의료기기 GMP의 개념
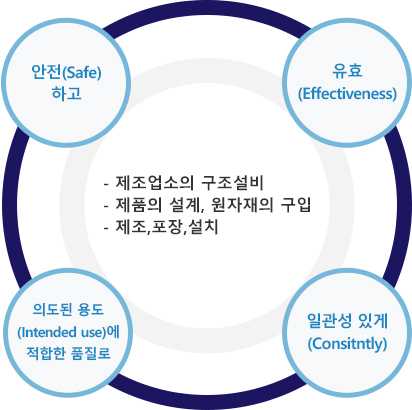
의료기기 GMP(Good Manufacturing Practice)은 의료기기 제조업자가 생산하는 의료기기가 안전(Safe)하고, 유효(Effecitve)하며, 의도된 용도(Intended use)에 적합한 품질로, 일관성(Consistently) 있게 생산됨을 높은 수준으로 보장하기 위한 품질보증 시스템입니다.

- - 제조업소의 구조설비
- - 제품의 설계, 원자재의 구입
- - 제조,포장,설치

| 의료기기 GMP 참여대상 | |
|---|---|
| 의료기기 제조업자 |
- 의료기기 제조 및 품질 관리 기준(GMP)을 준수 - 동기준에 적합할 판정받은 의료 기기를 판매 |
| 의료기기 수입업자 |
수입 및 품질관리기준을 준수 - 동기준에 적합함을 판정받은 의료기기를 판매 |
| 임상시험용 의료기기제조(업)자 | - 의료기기 제조 및 품질관리기준(GMP)에 따라 적합하게 제조된 것을 사용 |

- - 의료기기법 제 13조 (제조업자의 의무) / 의료기기법 제 14조 (수입업 허가등)
- - 의료기기법 시행규칙 제 15조 (제조업자의 준수사항 등) / 의료기기법 시행규칙 제 20조(수입업자의 준수사항 등)
- - 식품의약품안전처고시 (의료기기 제조 및 품질관리기준)
| 발급요건 |
· GMP 심사결과 적합판정시 (최초•추가•변경•정기심사) · 신청인의 추가발급 신청서 |
|---|---|
| 유효기간 |
· 적합인정서 발행일로부터 3년 · 추가심사 및 변경심사는 유효기간 영향無 |
| 발급기관 |
· 품질관리심사기관 · 식약처장 및 지방청장 공동명의 |
 GMP 적합인정 표시
GMP 적합인정 표시

|
- 주체 : 의료기기 품목허가를 받은 제조·수입업자 - 대상 : 의료기기 GMP 적합인정을 받은 제조·수입 의료기기 - 범위 : GMP 적합인정을 받은 품목군에 속한 모든 허가품목 |
- - 적합 인정 신청서 양식
- - 의료기기 제조 / 수입업 허가증 사본 (최초심사시는 제외)
- - 제조소 개요 : 명칭 / 주소, 약도, 제조소가 다수인 경우 모든 제조소 / 창고 등
- - 총 종업원의 수 : 제조 / 수입 및 품질 관련업무 종사자
- - 제조 / 수입 의료기기 품목 목록 : 품목 명, 등급을 포함
- - 품질경영시스템 적합인정서 사본 : 생산국 정부 등에서 발행한 ISO 13485 등
- - 제조소의 시설 개요 : 평면도, 제조(시험) 시설/장비 목록표
- - 주요 공급업체의 소재지 및 업무범위 : 위탁공정 계약 등 포함
- - 타 인증기관으로부터 받은 실사 결과
- - 품질매뉴얼(품질 방침 포함)
- - 수입은 해외 제조소의 문서
- - 제품표준서(승인된 문서 필요)
- - 신청 품목이 여러 개인 경우는 대표품(고등급/멸균품목을 우선) 1개의 문서로서 멸균, 소프트웨어 등 특정 제조공정에 대한 설명이 포함
- -------- 2019. 7. 1부터 제출자료 --------
- - (신청 품목의) 제품설명서 : 카다로그, 매뉴얼 등
- - 조직도
- - 품질문서 관리 개요
- - GMP 기준 점검표
- - GMP 기준 적합선언서
- - 대표품목 프로새스 및 서비스 유효성 확인 요약 자료
- - 대표품목 모니터링 및 측정 장비의 관리 요약 자료



 HOME
HOME